- 제목
- 정인권 교수 연구팀, 세포노화과정에서 활성산소종 생성 기작 규명
- 작성일
- 2018.04.05
- 작성자
- 생명시스템대학
- 게시글 내용
-
우리 대학 시스템생물학과 정인권 교수, 정미선 대학원생, 김미경 연구교수는 인간세포 노화과정에서 활성산소종(ROS, Reactive Oxygen Species)이 발생하는 새로운 메카니즘을 규명하여 생화학 및 분자생물학 분야의 세계적 국제 학술지인‘Nucleic Acids research (Impact factor 10.162)’ 온라인판에 게재하였다. (Loss of RNA-binding protein HuR facilitates cellular senescence through posttranscriptional regulation of TIN2 mRNA. Nucleic Acids Research. 2018. 3)
ROS가 세포 및 개체 수준에서 노화를 유발한다는 사실은 오랫동안 알려져 왔지만 세포노화과정에서 활성산소종이 발생하는 분자기작에 대해서는 알려져 있지 않다. 타겟 mRNA에 결합하여 유전자 발현을 조절하는 HuR 단백질은 세포노화과정에서 발현양이 감소함이 알려져 있고 텔로미어가 비정상적으로 작동할 때 세포노화가 유도되기 때문에 본 연구에서는 텔로미어 결합단백질 및 텔로머라제 구성단백질 중에 HuR의 타겟 유전자가 존재하는지 조사하였다. 흥미롭게도 텔로미어에 결합하는 6개 단백질(shelterin) 중에서 TIN2 mRNA의 3’UTR(untranslational region)에 HuR가 결합하여 유전자 발현을 억제함을 발견하였다. 노화된 세포에서 HuR의 발현양이 감소하면 TIN2 mRNA가 안정화되고 TIN2 단백질 발현양이 증가하게 된다. 그러나 이런 상황에서도 핵 내로 이동하는 TIN2 양은 변화가 없으나 증가된 TIN2는 미토콘드리아로 이동하여 ROS 생성을 촉진시킨다는 사실을 최초로 발견하였다. 이 결과는 shelterin 구성단백질인 TIN2가 텔로미어를 안정화시키는 기능 외에 미토콘드리아에서 ROS를 생성하는 이중기능을 수행함으로써 텔로미어와 미토콘드리아의 기능이 서로 연결되어 있음을 나타내고 있다. 본 연구결과를 통해 정상 체세포에서는 TIN2의 미토콘드리아 기능을 억제하여 세포노화를 지연시킬 수 있으며 암세포에서는 TIN2 기능을 촉진시켜 새로운 항암전략으로 유용하게 활용할 수 있는 길이 열리게 되었다.
본 연구는 정인권 교수 연구팀의 이지훈 박사(현재 U. of Texas at San Antonio 연구원)와 정미선 석ㆍ박사 통합과정 학생이 주도하였고 홍주영 박사(현재 U. of Texas at San Antonio 연구원)와 김미경 연구교수가 공동연구원으로 참여하였으며, 과학기술정보통신부가 주관하는 한국연구재단의 바이오·의료기술개발사업 및 당수식화 연구센터(GNRC) 사업으로 수행되었다.
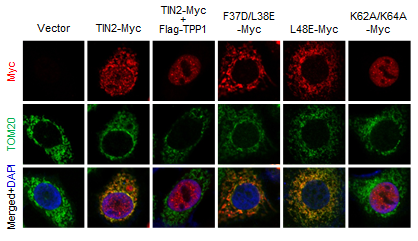
정상적인 TIN2 단백질은 핵(DAPI)과 미토콘드리아(TOM20)에 모두 위치하고 있으나 TPP1과 결합하지 못하는 TIN2 돌연변이 단백질(F37D/L38E와 L48E)은 미토콘드리아로만 이동하고 MTS(mitochondria targeting sequence)가 없는 돌연변이 단백질(L48E)은 핵으로만 이동한다. 미토콘드리아로 이동한 TIN2는 ROS 생성을 촉진하여 세포노화를 유도하게 된다.

왼쪽부터 김미경 연구교수, 정인권 교수, 정미선 대학원생