- 제목
- 권호정 교수팀, PPI 조절 가능한 생분해성 암 치료제 개발
- 작성일
- 2024.01.30
- 작성자
- 생명시스템대학
- 게시글 내용
-
임용범‧권호정 교수팀, PPI 조절 가능한 생분해성 암 치료제 개발
프로테옴 기능 조절을 통해 질병을 치료하는 ‘스마트 약물 전달 시스템’ 개발 초석 마련
약물 전달 분야 세계적 학술지 ‘Journal of Controlled Release’ 게재

[사진. (왼쪽부터) 임용범 교수, 권호정 교수, 가톨릭대 구희범 교수, 황현석 연구원]
공과대학 신소재공학과 임용범 교수, 생명시스템대학 생명공학과 권호정 교수 연구팀은 가톨릭대 의과대학 구희범 교수 연구팀과 공동 연구를 통해 낮은 약물동태학(pharmacokinetics) 특성을 보이는 기존 펩타이드 약물의 단점을 보완할 수 있는 나노바이오 소재를 개발했다. 이번에 개발한 자가조립 뎁시펩타이드 나노구조체(self-assembling depsipeptide nanostructure, SdPN)는 높은 생체 안정성과 암 조직 타기팅 능력을 가지며, 세포 안에 도달하면 주위의 환경을 인식한 후 자동적으로 생분해돼 단백질-단백질 상호 작용(PPI)을 저해하는 항암 펩타이드를 방출하는 스마트 약물 전달 시스템이다.
세포 내 신호 전달에 관여하는 ‘단백질-단백질 상호 작용(protein-protein interaction, PPI)’은 유망한 약물 타깃으로 간주되고 있지만, 구조적 특성상 넓고 얕은 결합면으로 이뤄지기 때문에 현재로서는 기존의 소분자(small molecule)를 이용한 약물 개발이 쉽지 않은 실정이다.
이에 다양한 기능성 잔기들을 가지고 있으며, 안정적인 이차 구조를 형성할 수 있고, PPI 인터페이스(interface)에 알맞은 크기를 가지고 있는 펩타이드가 효과적인 PPI 억제제로 작용할 수 있다. 하지만 펩타이드는 생체 내에서 약물의 신속한 가수분해(proteolytic digestion), 낮은 세포막 투과성(cell membrane permeability), 낮은 생체 이용률(bioavailability), 신장에서의 높은 제거율(renal clearance) 등과 같은 좋지 않은 약물동태학적 특성으로 인해 상용화가 쉽지 않은 상황이다.
PPI는 비극성 표면을 통한 소수성 상호 작용을 결합의 주요 원동력으로 사용한다. 특히, PPI 인터페이스에서 핵심 역할을 하는 핫스폿(hot spot)은 대부분 소수성을 띠는 동시에 알파 나선(α-helix)의 형태로 존재해, 타이트하고 특이적인 PPI를 가능하게 만들고 있다. 이에 펩타이드 라이브러리 스크리닝 기술을 활용해 PPI 인터페이스와 강력하게 상호 작용할 수 있는 알파 나선 기반의 펩타이드 약물을 찾는 연구가 활발히 진행 중이다.
이를 해결하기 위해, 본 연구에서는 PPI를 억제할 수 있는 알파 나선을 포함하는 자가조립 뎁시펩타이드 나노구조체(self-assembling depsipeptide nanostructure, SdPN)를 개발했다. SdPN은 체내에서 자가조립(self-assembly)을 유도하는 소수성 코어 부분, 소수성 코어 부분과 에스테르 결합으로 연결돼 세포 내 전달 이후 생분해를 통해 방출될 수 있는 알파 나선 펩타이드 약물 부분, 세포 투과 펩타이드 부분으로 이뤄져 있다. 알파 나선 펩타이드 약물 부분은 핫스폿이 주로 소수성 잔기로 이뤄져 있다는 것에 착안해, 자가조립 과정에 참여하게 디자인했다. 합성한 펩타이드를 물에 녹이면 자가조립을 통해 자동적으로 분자들이 모여 나노캡슐 모양의 구조를 만드는 것을 검증했다(그림 A).
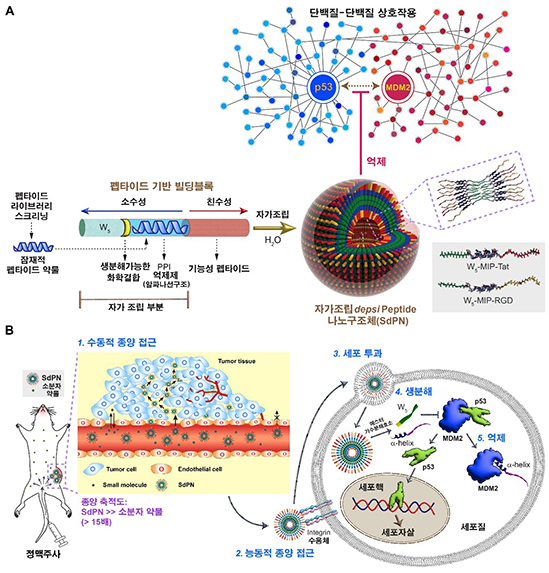
[그림. 연구 개요 (A) 단백질-단백질 간 상호 작용을 억제할 수 있는 자가조립 뎁시펩타이드 나노구조체(SdPN)의 구성 요소 및 자가조립 나노구조체의 구조. (B) SdPN의 암 조직 제거 작동 메커니즘]
해당 구조체의 알파 나선 펩타이드 약물 부분은 암세포의 세포 자살에 관련된 p53과 MDM2 간 상호 작용을 억제하는 MIP(MDM2 Inhibitory Peptide)로 구성했다. SdPN은 체내 환경에서 안정적인 알파 나선 구조를 유지하고 있었으며, 세포 내 전달 후 기존의 소분자(small molecule) 약물의 급격한 억제 작용과는 대조적으로 에스터 결합의 점진적인 생분해를 통해 펩타이드 약물을 서서히 방출했다(controlled release, 그림 B). 또한 동물 실험 결과, 기존의 소분자 약물 대비 고효율로 종양에 전달돼 강력한 항암 효과를 보이는 것을 확인했다.
SdPN은 모듈형이기 때문에, MIP 외에 다른 약물로의 교체가 자유로운 것이 특징이다. 따라서 범용성 PPI 조절 플랫폼으로 개발될 수 있다는 특장점이 있다.
이번 논문은 최세환, 황현석, 한성령 연구원이 공동 제1저자로, 엄호현, 최준식, 한상헌, 이동현, 이수연 연구원이 공동저자로, 임용범 교수, 권호정 교수, 가톨릭대 의과대학 구희범 교수가 교신저자로 참여했으며, 한국연구재단, 우리 대학교 ICONS 사업, 가톨릭교육재단의 연구비 지원으로 진행됐다. 본 논문은 약물 전달 분야의 세계적인 학술지인 ‘저널 오브 컨트롤드 릴리즈(Journal of Controlled Release, IF 10.8, JCR 상위 3.9%)’에 2024년 1월 게재됐다.
논문정보
● 논문 제목: Inhibition of protein-protein interactions using biodegradable depsipeptide nanoassemblies